Pengertian, Rumus dan Cara Menghitung Potensial sel standar (E°sel)
Tahukah kamu, bahwa potensial sel Volta dapat ditentukan melalui eksperimen dengan menggunakan voltmeter.
Disamping itu, data potensial elektrode positif atau katode dan potensial elektrode negatif atau anode juga dapat digunakan untuk menentukan potensial sel standar dengan menggunakan rumus di bawah ini.
E° sel = E°(katode) - E°(anode)
atau
E° sel = E°(reduksi) - E°(oksidasi)
atau
E° sel = E°(reduksi) - E°(oksidasi)
Agar lebih mudah memahami cara menggunakan rumus di atas, maka perhatikan contoh soal di bawah ini.
Contoh Soal Cara Menghitung dan Menentukan Potensial sel standar (E°sel)
Contoh Satu
Diketahui, suatu reaksi berdasarkan potensial standar elektrode seperti data berikut.Mg2+(aq) + 2e- → Mg(s), E° = - 2,37 V
Br2(g) + 2e- → 2Br-(aq), E° = +1,07 V
- Tentukan potensial sel standar (E°sel)
- Tuliskan reaksi selnya.
a. Tentukan potensial sel standar (E°sel)
E° sel = E°(katode) - E°(anode)
E° sel = 1,07 V - (- 2,37 V) = 3,44 V
Brom mempunyai potensial elektrode standar positif, sehingga sebagai katode atau kutub positif dan magnesium sebagai anode atau kutub negatif.
b. Reaksi sel
Katode : Br2(g) + 2e- → 2Br-(aq) E° = +1,07 V (reaksi reduksi)
Anode : Mg2+(aq) + 2e- → Mg(s) E° = - 2,37 V (reaksi reduksi)
Pada katode terjadi reaksi reduksi, sedangkan pada anode terjadi reaksi oksidasi, maka persamaan reaksi di atas yang terjadi pada anode harus dibalik reaksinya supaya menjadi reaksi oksidasi.
Karena Magnesium yang bertindak sebagai anode, maka reaksinya harus dibalik sehingga reaksi sel yang terjadi dapat ditulis menjadi berikut ini.

Soal Dua
Diketahui berdasarkan potensial standar elektrode berikut ini.Ag (aq) + e- → Ag(s), E° = +0,80 V
Cu2+(aq) + 2e- → Cu(s), E° = +0,34 V
- Tentukan potensial sel standar (E°sel).
- Tuliskan reaksi selnya.
a. Tentukan potensial sel standar (E°sel)
Berdasarkan harga potensial elektrodenya, maka tembaga (Cu) lebih mudah mengalami reaksi oksidasi karena potensial elektrodenya lebih kecil dari pada perak (Ag), sehingga perak sebagai katode dan tembaga sebagai anode.
E° sel = E°(katode) - E°(anode)
E° sel = 0,80 V - (0,34 V)
E° sel = 0,46 V
b. Reaksi sel
Katode : Ag+(aq) + e- → Ag(s) E° = +0,80 V (×2)
Anode : Cu(s) → Cu2+(aq)+ 2e- E° = - 0,34 V (×1)
Persamaan reaksi di atas, koefisien reaksi dari perak harus dikalikan dua untuk menyamakan jumlah elektron yang terlibat. Tetapi perlu diingat bahwa nilai potensial elektrode tidak tergantung pada koefisien reaksi, sehingga tidak ikut dikalikan. Reaksi selnya:
Katode : 2Ag+(aq) + 2e- → 2Ag(s) E° = +0,80 V
Anode : Cu(s) → Cu2+(aq)+ 2e- E° = - 0,34 V
Soal Tiga
Tentukan potensial sel Volta, jika diketahui potensial sel lain yang menggunakan elektrode yang sama.Diketahui:
Mg(s) * Mg2+(aq) 2Cu2+(aq) *Cu(s) E° = +2,71 V
Zn(s) * Zn2+(aq) 2Cu2+(aq) *Cu(s) E° = +1,1 V
Tentukan potensial sel standar Mg(s) * Mg2+(aq) 2Zn2+(aq) *Zn(s).
Jawab
Untuk menjawab pertanyaan ini, harus disusun sel-sel yang diketahui sehingga jika dijumlahkan akan menghasilkan sel yang dimaksud.
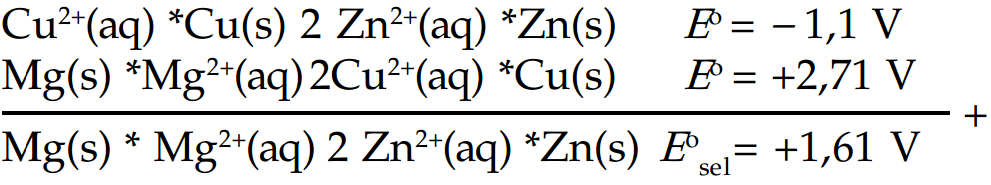
Baca Juga
- 1 Mengenal Apa Itu Sel Elektrokimia
- 2 Mengenal Sel Volta atau Sel Galvani
- 3 Apa itu Notasi sel Volta
- 4 Memahami Pengertian Potensial Elektrode Standar
- 5 Pengertian Potensial elektrode
- 6 Pengertian, Rumus dan Cara Menghitung Potensial sel standar (E°sel)
- 7 Apa itu Spontanitas reaksi redoks dan Contohnya
- 8 Mengenal dan Memahami Persamaan Nerst