Pengertian Potensial elektrode
Sel Volta terdiri dari dua macam reaksi setengah sel, oleh karena itu tidak memungkinkan untuk mengukur potensial setengah sel tunggal, sehingga yang dapat dilakukan adalah hanya mengukur potensial dari kedua reaksi setengah sel tersebut.
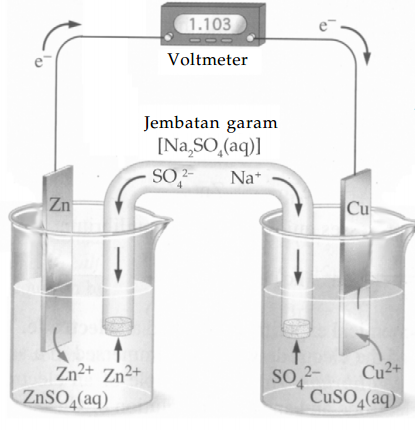
Jika kita ingin membandingkan potensial setengah sel yang satu dengan potensial setengah sel yang lainnya, maka harus diukur potensial masing-masing terhadap petensial setengah sel ketiga sebagai pembanding.
Ahli-ahli kimia memilih menggunakan elektrode hidrogen (H2) sebagai standar dengan harga potensialnya nol sebagai elektrode pembanding standar.
Voltase sel tersebut diambil sebagai pengukuran kecenderungan setengah sel zat untuk menjalani reaksi oksidasi atau reaksi reduksi, jika dibandingkan dengan kecenderungan setengah sel H2 / H+.
Catatan:
Oksidasi berarti peningkatan bilangan oksidasi. Reduksi berarti penurunan bilangan oksidasi.
Dalam sel pembanding ideal, elektrode hidrogen merupakan setengah sel yang satu dan elektrode standar dari zat yang akan dibandingkan merupakan setengah sel yang lainnya. Misalnya elektrode tembaga standar, voltase ideal yang ditunjukkan oleh voltmeter adalah pada angka 0,34 V.
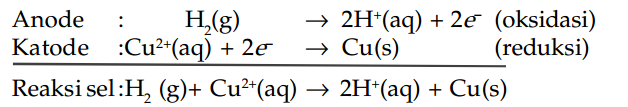
Jika elektrodenya berupa magnesium, maka voltase idealnya adalah 2,37 V dengan simpangan jarum voltmeter pada arah yang berlawanan.
Simpangan ini menandakan bahwa atom magnesium yang dioksidasi dengan memberikan elektronnya, bukan hidrogen.
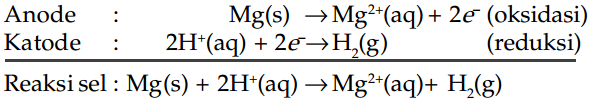
Bagaimana jika elektrodenya adalah nikel, maka arah simpangan voltmeter sama dengan arah untuk magnesium, di mana voltase idealnya adalah 0,25 V.
Voltase yang lebih rendah menunjukkan bahwa kecenderungan nikel menyerahkan elektron kepada ion hidrogen lebih rendah daripada magnesium.
Reaksi keseluruhan yang berlangsung spontan dalam sel-sel pembanding dapat ditampilkan sebagai berikut.
Ni(s) + 2H+ (aq) → Ni2+(aq) + H2(g) (oksidasi Ni, E° = + 0,25 V)
H2(g) + Cu2+ (aq) → 2H+(aq) + Cu(s) (reduksi Cu2+, E° = +0,34 V)
Berdasarkan uraian data di atas, dapat diperoleh susunan ketiga unsur berdasarkan kecenderungannya teroksidasi, adalah Mg > Ni > Cu.
Potensial sel yang dihasilkan dari suatu elektrode dengan elektrode hidrogen disebut sebagai potensial elektrode dan disimbolkan dengan lambang E°.
Elektrode hidrogen yang mempunyai potensial elektrode bertanda positif karena lebih mudah mengalami reduksi, sedangkan elektrode yang lebih sulit mengalami reduksi diberi tanda negatif.
Pada Tabel Potensial elektrode standar, E°sel, dapat dilihat bahwa elektrode yang mempunyai potensial negatif diletakkan di atas elektrode hidrogen, sedangkan yang bertanda positif diletakkan pada bagian bawah elektrode hidrogen.
Menurut aturan, potensial elektrode dikaitkan dengan reaksi reduksi, sehingga potensial elektrode sama dengan potensial reduksi. Sedangkan potensial oksidasi sama dengan potensial reduksi, namun tandanya dibuat berlawanan.
Baca Juga
- 1 Mengenal Apa Itu Sel Elektrokimia
- 2 Mengenal Sel Volta atau Sel Galvani
- 3 Apa itu Notasi sel Volta
- 4 Memahami Pengertian Potensial Elektrode Standar
- 5 Pengertian Potensial elektrode
- 6 Pengertian, Rumus dan Cara Menghitung Potensial sel standar (E°sel)
- 7 Apa itu Spontanitas reaksi redoks dan Contohnya
- 8 Mengenal dan Memahami Persamaan Nerst