Mengenal Sel Volta atau Sel Galvani
Pengertian Sel Volta
Sel Volta adalah penataan bahan kimia serta penghantar listrik yang memberikan aliran elektronnya melalui rangkaian luar dari suatu zat kimia yang teroksidasi ke zat kimia yang direduksi.
Perlu di ingat bahwa, jika kita berbicara tentang Sel Volta, maka sama saja dengan menyebutnya sebagai sel Galvani.
Tahukah kamu
Apakah kalian tahu, bahwa jika buah jeruk ditancapkan dengan dua keping logam yang berbeda seperti seng dan tembaga, maka akan dapat menghasilkan energi listrik.
Dalam sel volta terjadi proses oksidasi dan reduksi. Reaksi oksidasi berarti terjadi pelepasan elektron oleh atom, molekul, atau ion. Sedangkan reaksi reduksi berarti diperolehnya elektron oleh partikel-partikel ini.
Contoh reaksi oksidasi dan reduksi spontan sederhana yang terjadi pada sel volta adalah seperti persamaan reaksi seng dengan tembaga di bawah ini.
Reaksi spontan ion tembaga berubah menjadi logam tembaga akan menyepuh atau melapisi lembaran seng, lembaran seng melarut, dan dibebaskan energi panas.
Reaksi di atas dapat dituliskan dalam bentuk persamaan ion seperti di bawah ini.
Setiap atom seng kehilangan dua buah elektron untuk menjadi sebuah ion seng dan setiap ion tembaga akan memperoleh dua elektron menjadi sebuah atom tembaga.
Reduksi : Cu2+(aq) + 2e- → Cu(s)
Meskipun proses oksidasi dan reduksi memiliki sifat dasar berupa listrik, namun aliran elektron tak dapat dideteksi jika seng bersentuhan langsung dengan larutan tembaga sulfat.
Elektron tersebut diberikan secara langsung dari atom-atom seng ke ion-ion tembaga.
Salah satu metode atau cara yang memungkinkan untuk difusi ion-ion adalah dengan membenamkan lembaran seng ke dalam suatu larutan garam seng, seperti pada seng sulfat dan membenamkan sepotong tembaga ke dalam suatu larutan tembaga sulfat.
Larutan seng sulfat dihubungkan dengan larutan tembaga sulfat oleh jembatan garam, yang memungkinkan terjadinya proses difusi ion-ion.
Jembatan garam diisi dengan larutan elektrolit dari garam yang tidak berubah secara kimia dalam proses di atas.
Sebagai contoh misalnya pada kalium sulfat, natrium sulfat, natrium klorida, kalium klorida, dan kalium nitrat.
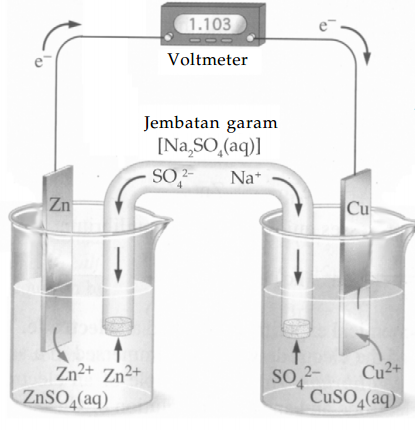
Perhatikan di atas. Reaksi akan terus berlangsung hingga atom seng atau ion tembaga habis terpakai dan voltase menjadi sama dengan nol.
Zn secara spontan berubah menjadi Zn+ setelah melepaskan elekton. Elektron mengalir dari atom seng menuju ke kawat penghantar menuju logam tembaga.
Ion negatif berdifusi melalui jembatan garam menuju lembaran seng sampai lembaran seng habis. Elektron yang dilepaskan oleh atom seng memasuki kawat penyambung dan menyebabkan elektron-elektron pada ujung lain berkumpul pada permukaan logam tembaga. Elektron-elektron tersebut bereaksi dengan ion tembaga membentuk atom tembaga yang melekat pada permukaan itu sebagai sepuhan tembaga.
Pada gambar di atas, ion SO42– yang ditinggalkan oleh ion tembaga akan berdifusi menjauhi elektrode tembaga. Kemudian ion Na+ dari jembatan garam akan berdifusi keluar menuju ke tembaga.
Dapat dikatakan bahwa, sementara reaksi di atas berlangsung terdapat gerakan keseluruhan dari ion negatif menuju lembaran seng dan gerakan keseluruhan ion positif menuju logam tembaga.
Jalan untuk aliran ion secara terarah melalui larutan ini dapat dibayangkan sebagai rangkaian dalam dan untuk jalan aliran elektron lewat kawat penghantar dibayangkan sebagai rangkaian luar.
Baterai yang tersusun atas seng, seng sulfat, tembaga, dan tembaga sulfat disebut sel Daniell, seperti nama penemunya.
Logam seng dan tembaga yang merupakan kutub-kutub pada rangkaian sel elektrokimia disebut sebagai elektrode.
Elektrode tempat terjadinya reaksi oksidasi disebut anode, sedangkan elektrode tempat terjadinya reaksi reduksi disebut katode.
Karena oksidasi merupakan pelepasan elektron, maka anode adalah kutub negatif, sedangkan katode merupakan kutub positif.
Pada sel Daniell yang telah dijelaskan sebelumnya, anodenya adalah logam seng dan katodenya adalah logam tembaga.
Tembaga merupakan salah satu barang tambang yang ada di Indonesia. Tambang tembaga terdapat di Cikotok, Sangkarapi, Kompara, Jawa Barat, Papua, Sulawesi Selatan, dan Tirtamaya, Jawa Tengah. Tambaga termasuk bahan baku yang digunakan untuk membuat kabel listrik.
Baca Juga
- 1 Mengenal Apa Itu Sel Elektrokimia
- 2 Mengenal Sel Volta atau Sel Galvani
- 3 Apa itu Notasi sel Volta
- 4 Memahami Pengertian Potensial Elektrode Standar
- 5 Pengertian Potensial elektrode
- 6 Pengertian, Rumus dan Cara Menghitung Potensial sel standar (E°sel)
- 7 Apa itu Spontanitas reaksi redoks dan Contohnya
- 8 Mengenal dan Memahami Persamaan Nerst