Macam-macam Baterai dan Sel Bahan Bakar
Pada artikel materi kali ini kita akan melihat tentang macam-macam baterai dan sel bahan bakar. Kalian tentu tahu ada banyak jenis baterai seperti baterai kering, baterai basa, dan sebagainya. Yuk, simak penjelasan di bawah ini.
1. Baterai kering atau Sel Leclanche
Tahukah kalian, baterai yang paling umum atau paling sering dan banyak digunakan orang disebut sel atau baterai kering.
Baterai kering ditemukan oleh Leclanche yang mendapat hak paten pada tahun 1866.
Kalian dapat melihat susunan baterai kering pada gambar di bawah ini.

Pada gambar di atas, logam seng bertindak sebagai elektrode negatif dan juga sebagai wadah komponen baterai yang lainnya.
Elektrode positif adalah karbon tak reaktif yang diletakkan pada pusat kaleng.
Baterai ini disebut sebagai kering, karena hanya terdapat kandungan air yang relatif rendah, meskipun begitu kelembaban mutlak diperlukan agar ion-ion dalam larutan dapat berdifusi di antara elektrode-elektrode tersebut.
Jika baterai memberikan arus, maka reaksi pada elektrode negatif akan melibatkan oksidasi seng.
Reaksi pada elektrode positif bisa dibilang cukup rumit, tapi secara garis besar dapat kita tuliskan dalam persamaan sebagai berikut.

Sebuah baterai kering mempunyai potensial energi listrik sebesar 1,5 volt dan tidak dapat diisi ulang. Baterai kering banyak digunakan untuk peralatan yang menggunakan arus kecil seperti radio dan kalkulator.
2. Baterai Alkalin
Selain baterai kering, ada juga sel yang sering digunakan sebagai ganti baterai kering yaitu baterai alkalin.
Baterai alkalin terdiri dari anode seng, katode mangan dioksida dan elektrolit kalium hidroksida.
Reaksi yang terjadi pada baterai alkalin dapat ditampilkan sebagai berikut.
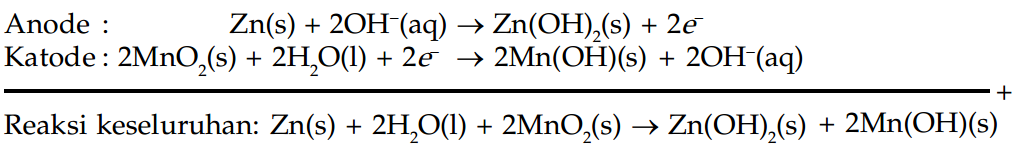
Baterai alkalin bersifat basa.
Potensial dari baterai alkalin adalah 1,5 volt. Tapi dapat bertahan lebih lama dan dapat menghasilkan dua kali energi total baterai kering pada ukuran yang sama.
Baterai alkalin digunakan untuk peralatan yang memerlukan arus lebih besar misalnya pada tape recorder.
3. Baterai perak oksida
Baterai perak oksida adalah baterai berukuran kecil yang sering digunakan sebagai sumber tenaga dalam alat bantu pendengaran, kalkulator, dan arloji.
Bagan sel pada baterai perak oksida diperlihatkan seperti pada gambar dibawah ini.

Untuk reaksi yang terjadi pada baterai perak oksida dapat ditampilkan seperti persamaan di bawah ini.

4. Aki
Aki termasuk jenis baterai yang menjadi penyimpanan potensial sebuah automobil yang dapat diisi ulang.
Aki terbuat dari lempeng timbel yang menyerupai bunga karang dan timbel dioksida yang dibuat secara berselang-seling dan disekat dengan kayu atau serat kaca dan dibenamkan dalam suatu elektrolit.
Elektrolit yang digunakan adalah asam sulfat(H2SO4) dalam air(H2O).
Jika aki memberikan arus, maka lempeng timbal (Pb) bertindak sebagai anode dan lempeng timbal dioksida (PbO2) akan bertindak sebagai katode.

Reaksi pada aki antara lempeng timbal dan timbal dioksida dapat ditampilkan sebagai berikut.

Pada persamaan di atas, timbal sulfat terbentuk pada kedua elektrode. Karena timbal sulfat tak dapat larut, maka timbal sulfat terdepositokan pada kedua elektrode di mana garam ini terbentuk.
Asam sulfat digunakan dan terbentuk air (H2O). Karena asam sulfat berbentuk encer dan kurang rapat dibandingkan asam sulfat pekat aslinya, maka rapatan larutan elektrolit ini biasanya diukur untuk menetapkan sejauh mana aki telah dipakai.
Pengisian ulang aki termasuk suatu pemaksaan terhadap elektron untuk melewati aki dengan arah berlawanan.
Dalam proses elektrolisis di atas semua perubahan kimia dibalik.
Timbal sulfat dan air di ubah kembali menjadi timbal, timbal dioksida, dan asam sulfat.
Reaksi pengisian kembali pada aki dapat ditampilkan seperti persaamaan berikut.

Jika diisi secara penuh, maka sebuah aki memiliki potensial sel sekitar 2,1 V. Aki mobil dengan enam sel memiliki potensial sekitar 12 V.
5. Baterai Udara
Baterai udara menggunakan gas oksigen (O2(g)) dari udara sebagai oksidator Seng atau aluminium berperan sebagai reduktor.
Pada baterai udara aluminium, oksidasi terjadi pada anode aluminium dan reduksi pada katode karbon.
Pada baterai udara, larutan elektrolit yang digunakan melewati baterai adalah Natrium Hidroksida atau NaOH.
Aluminium dioksidasi menghasilkan Al3+, karena kemolaran OH- bersifat pekat maka terbentuk ion kompleks [Al(OH)]- dengan persamaan reaksi yang ditampilkan sebagai berikut.

Baterai udara dapat digunakan untuk menggerakan mobil beberapa km sebelum bahan bakar ditambahkan.
6. Sel bahan bakar
Sel bahan bakar biasanya menggunakan oksigen sebagai katode dan suatu gas yang dapat dioksidasi sebagai anode.
Reaksi yang terjadi dapat ditampilkan sebagai berikut

Penggunaan yang paling krusial dari sel bahan bakar namun sulit direalisasikan adalah sebagai pembangkit tenaga listrik alternatif, yang hanya sedikit menimbulkan pencemaran udara dan pencemaran terminal pada sungai dibandingkan dengan pembangkit tenaga listrik dengan batu bara.
Sel elektrokimia dimasukkan ke dalam sel primer dan sel sekunder. Sel Daniell, sel Leclanche, dan sel perak oksida termasuk sel primer, sedangkan aki dan sel bahan bakar termasuk sel sekunder.
Materi Terkait
- 1 Mengenal Susunan Deret Volta
- 2 Macam-macam Baterai dan Sel Bahan Bakar
- 3 Mengenal Elektrolisis, Sel Elektrolisis, dan Susunan Sel Elektrolisis
- 4 Cara Menentukan dan Meramalkan Reaksi Elektrolisis
- 5 Mengenal Hukum Faraday, Bunyi Hukum Faraday, dan Cara Menggunakan Hukum Faraday
- 6 Aplikasi dan Penerapan Elektrolisis
- 7 Pengertian Korosi, Faktor Penyebab Korosi, dan Tehnik Pencegahan Korosi