Cara Menentukan dan Meramalkan Reaksi Elektrolisis
Hal-hal Yang Perlu Diperhatikan Dalam Menulis Reaksi Elektrolisis
Dalam proses reaksi elektrolisis, kita mengetahui bahwa terdapat beberapa faktor yang mempengaruhi hasil elektrolisis itu. Oleh karena itu dalam menuliskan reaksi elektrolisis perlu memperhatikan hal berikut.
1. Apakah ada Terjadi Overpotensial
Hal pertama yang perlu diperhatikan dari reaksi elektrolisis adalah apakah ada terjadi overpotensial.
Secara umum Overpotensial terjadi jika reaksinya melibatkan gas. Sebagai contoh overpotensial yang terjadi pada penggunaan sel dengan H2(g) pada katode raksa kira-kira 1,5 V, sedangkan pada katode platina adalah 0 (nol).
2. Apakah ada Mengandung Spesi Yang Dapat Melakukan Oksidasi dan Reduksi
Jika zat yang dielektrolisis mengandung beberapa spesi yang dapat menjalani oksidasi serta reduksi, maka akan terjadi kompetisi reaksi pada elektrode.
Misalnya pada larutan NaCl cair yang dielektrolisis dengan mengalirkan arus listrik ke dalam lelehan NaCl tersebut, maka terjadi satu reaksi oksidasi dan satu reaksi reduksi, di mana NaCl(l) akan terurai dan menjadi logam natrium dan gas klor.

Elektrolisis pada NaCl(aq) dapat terjadi dalam dua macam setengah reaksi oksidasi dan dua macam setengah reaksi reduksi.
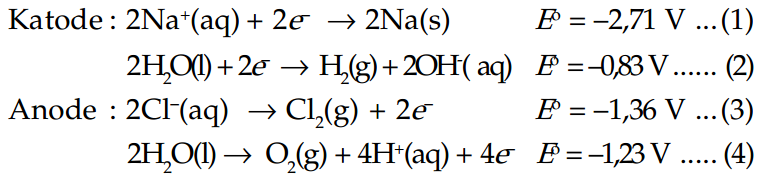
Untuk setengah reaksi oksidasi potensial elektrode pada persamaan (3) dan (4) memiliki besar yang sama. Harga yang tepat tergantung pada Cl– dan H+.
Jika larutan NaCl dipekatkan, maka cenderung akan terjadi reaksi ke (3) atau pembentukan klor. Jika larutan NaCl diencerkan, maka cenderung yang terjadi adalah reaksi ke (4) atau pembentukan gas oksigen.
Untuk setengah reaksi reduksi yang cenderung terjadi reaksi ke (2) atau reduksi air. Namun jika raksa yang digunakan sebagai katode, maka yang cenderung terjadi reaksi (1). Ini dikarenakan overpotensial gas hidrogen pada raksa tinggi.
Dari penjelasan di atas dapat kita simpulkan bahwa spesi yang mengalami reduksi di katode adalah yang mempunyai potensial elektrode lebih positif. Sedangkan spesi yang mengalami oksidasi di anode adalah yang mempunyai potensial elektrode yang lebih negatif.
Elektrode inert atau elektrode aktif
Elektrode yang digunakan pada elektrolisis NaCl(l) dan NaCl(aq) merupakan elektrode yang inert.
Elektrode inert adalah elektrode yang tidak terlibat dalam reaksi.
Kebalikan dari elektrode inert adalah elektrode aktif.
Elektrode aktif adalah elektrode yang terlibat langsung dalam setengah reaksi, sehingga dalam meramalkan reaksinya kita harus mempertimbangkan bahan dari elektrode yang digunakan. Perhatikan contoh di bawah ini.
Ramalkan reaksi elektrolisis larutan AgNO3 yang dielektrolisis menggunakan
- Elektrode platina
- Anode perak dan katode platina
a. Elektrode platina
Pada elektrode platina, karena bersifat inert sehingga yang ada dalam larutan hanya ion Ag+, ion NO3–, dan molekul air.
Potensial reduksi ion perak lebih positif daripada air sehingga ion perak lebih mudah direduksi.
Katode : Ag+(aq) + e– → Ag(s), E° = 0,800 V
Karena ion NO3 mempunyai atom N dengan bilangan oksidasi paling tinggi (+5), maka tidak dapat dioksidasi, sehingga reaksi oksidasi yang mungkin hanya molekul air.
Anode : 2H2O(l) → O2(g) + 4H+(aq) + 4e–, E° = –1,23 V
Reaksi elektrolisis yang terjadi
4Ag+(aq) + 2H2O(l) →(elektrolisis)→ 4Ag(s) + O2(g) + 4H+(aq)
b. Anode perak dan katode platina
Setengah-reaksi reduksi pada katode sama dengan dengan soal (a).
Katode : Ag+(aq) + e– → Ag(s), E° = 0,800 V
Tetapi anode perak merupakan elektrode aktif, sehingga yang teroksidasi pada anode adalah perak.
Anode : Ag(s) → Ag+(aq) + e–
Keseluruhan reaksi elektrolisis merupakan perpindahan Ag sebagai Ag+ melalui larutan dari anode ke katode.
Ag(s) anode →(elektrolisis)→ Ag(s) katode
Materi Terkait
- 1 Mengenal Susunan Deret Volta
- 2 Macam-macam Baterai dan Sel Bahan Bakar
- 3 Mengenal Elektrolisis, Sel Elektrolisis, dan Susunan Sel Elektrolisis
- 4 Cara Menentukan dan Meramalkan Reaksi Elektrolisis
- 5 Mengenal Hukum Faraday, Bunyi Hukum Faraday, dan Cara Menggunakan Hukum Faraday
- 6 Aplikasi dan Penerapan Elektrolisis
- 7 Pengertian Korosi, Faktor Penyebab Korosi, dan Tehnik Pencegahan Korosi