Aplikasi dan Penerapan Elektrolisis
Kalian tentu tahu bahwa dalam bidang industri tentu saja tidak lepas dari yang namanya kimia. Dalam pemanfaatan atau penerapannya terdapat beberapa aplikasi penggunaan elektrolisis khususnya pada dunia industri. Salah satunya adalah memproduksi zat-zat kimia dan untuk pemurnian logam.
Pada artikel materi kali ini, kita akan melihat tentang beberapa aplikasi elektrolisis pada industri ini.
1. Pemanfaatan Elektrolisis Dalam Memproduksi Zat
Elektrolisis berperan penting dalam industri manufaktur dan pemurnian zat kimia. Beberapa zat kimia yang dapat diperoleh melalui proses elektrolisis diantaranya adalah seperti natrium, kalsium, magnesium, aluminium, tembaga, seng, perak, hidrogen, klor, fluor, natrium hidroksida, kalium dikromat, dan kalium permanganat.
Salah satu proses elektrolisis yang penting dalam keperluan komersial adalah elektrolisis larutan natrium klorida.
Proses elektrolisis larutan natrium klorida sering disebut proses klor-alkali.
Pemanfaatan elektrolisis larutan NaCl menghasilkan natrium hidroksida di katode dan gas klor pada sisi anode.
Kita dapat menuliskan reaksinya secara keseluruhan sebagai berikut.
Permasalahan yang sering kita hadapi pada proses klor-alkali adalah bagaimana caranya agar kita dapat menjaga gas klor yang terbentuk tidak kontak dengan larutan NaOH. Dalam larutan alkali Cl2 akan terdispro-porsionasi menghasilkan ClO– dan Cl–.
Untuk mencegah agar tidak terjadi kontak langsung antara gas klor dengan larutan NaOH, maka ruang katode dan anode kita pisahkan menggunakan sekat yang disebut sel diafragma.
Sel diafragma juga menjaga agar tidak bercampurnya gas hidrogen dan gas klor, karena kedua gas tersebut dapat menyebabkan terjadinya ledakan apabila bercampur.
Sel diafragma terbuat dari suatu selaput berpori yang dapat dilalui ion-ion, tapi tetap dapat menahan percampuran larutan.
Anode pada sel diafragma dibuat secara khusus dari logam titanium. Diafragma dan katode terdiri atas unit yang terbuat dari polimer asbes dan ditempatkan pada logam berpori.
Ruang katode yang dipisahkan oleh sel diafragma mengandung campuran NaOH (10-12%) dan NaCl (14-16%).
Larutan dari ruang katode dipekatkan dengan penguapan dan pemurnian dengan pengkristalan natrium klorida. Hasil akhir dalam proses klor-alkali adalah 50% NaOH(aq) dengan 1% NaCl sebagai pengotor.
Klor yang dihasilkan juga mendapat 1,5% O2(g) sebagai pengotor yang disebabkan proses oksidasi.
Harga Eosel menunjukkan bahwa elektrolisis NaCl(aq) hanya memerlukan arus searah dengan tegangan lebih dari 2,19 V. Karena tahanan dalam dari sel elektrolisis dan overpotensial pada elektrode, maka diperlukan suatu tegangan yang agak lebih tinggi, yaitu sekitar 3,5 V.
Jika sebuah arus 1 A dilewatkan melalui sel diafragma secara kontinu atau berkelanjutan selam 24 jam, jumlah Cl2 yang diperoleh hanya 32 gram. Ini merupakan kecepatan produksi yang tidak berarti untuk tujuan komersial. Jika sebuah sel menghasilkan 1 ton Cl2 per hari, maka diperlukan arus sekitar 31 A.
Proses elektrolisis pada industri klor-alkali memerlukan sekitar 0,5 % dari seluruh daya listrik yang diproduksi tiap tahun di Amerika Serikat.
2. Pemanfaatan Elektrolisis Dalam Sel merkuri
Hasil dari proses sel diafragma banyak dimanfaatkan untuk berbagai keperluan, misalnya pada pembuatan rayon memerlukan NaOH(aq) dengan kemurnian yang tinggi.
Suatu proses elektrolisis yang menghasilkan NaOH(aq) dengan kemurnian yang lebih tinggi adalah sel merkuri.
Katode merkuri memiliki overpotensial yang lebih tinggi untuk mereduksi H2O menjadi OH– dan H2(g), sehingga reduksi yang terjadi adalah Na+(aq) menjadi Na(l) yang larut dalam merkuri membentuk suatu amalgam berupa 0,5 % Na.
Reaksi yang terjadi dalam sel merkuri dapat dituliskan seperti persamaan di bawah ini.

Jika amalgam Na yang dikeluarkan dari sel ditambah air, maka akan terbentuk NaOH(aq) dan merkuri cair dikembalikan lagi ke dalam sel elektrolisis.
Keuntungan sel merkuri dapat menghasilkan NaOH pekat dengan kemurnian yang tinggi. Kelemahan sel merkuri adalah memerlukan energi listrik yang lebih banyak, selain itu merkuri mempunyai dampak negatif terhadap lingkungan.
3. Pemanfaatan Elektrolisis Dalam Sel membran
Proses klor-alkali yang ideal adalah memiliki efisiensi dari segi energi dan tidak membahayakan lingkungan.
Jenis sel yang memberikan keuntungan seperti di atas adalah sel membran.
Sel membran sama dengan sel diafragma, hanya saja diafragma berpori diganti dengan suatu membran penukar kation dari polimer.
4. Pemanfaatan Elektrolisis Dalam Elektroplating
Elektroplating atau lebih sering disebut dengan penyepuhan adalah proses elektrolisis yang dapat digunakan untuk melapisi logam dengan logam lainnya.
Elektroplating secara umum sering dimanfaatkan untuk melindungi logam dari korosi dan memperbaiki penampilan benda.
Biasanya benda yang disepuh terbuat dari logam yang murah seperti besi lalu disepuh dengan logam yang mahal seperti emas dan perak. Harga produk akhir menjadi jauh lebih mahal jika logam tersebut disepuh.
Sebagai contoh jam tangan yang dilapisi dengan emas atau sendok yang dilapisi dengan perak melalui proses elektroplating.
Proses elektroplating perak dapat dilihat pada di bawah ini. Sendok dari besi yang akan dilapisi dengan perak diletakkan sebagai katode, sedangkan sepotong logam perak murni sebagai anodenya. Berikut adalah reaksi yang terjadi antara sendok besi yang dilapisi perak.
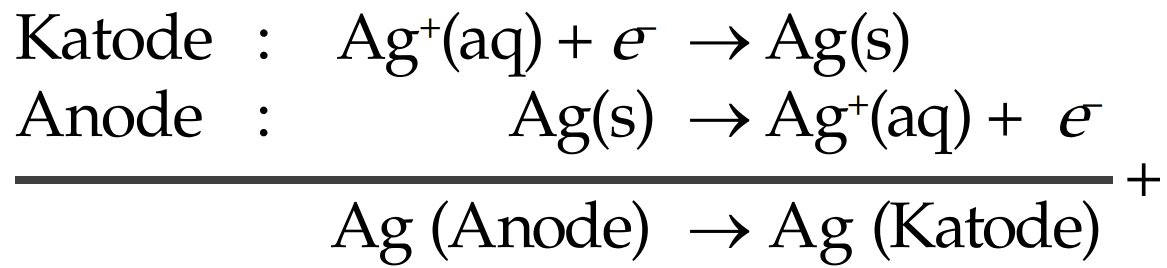

Dalam industri skala besar elektroplating sering digunakan untuk proses pemurnian logam tembaga. Tembaga dengan kemurnian tinggi sangat diperlukan khususnya jika digunakan sebagai penghantar listrik seperti kabel.
Karena pengotor dapat mengurangi konduktivitas listrik tembaga, maka tembaga kotor dijadikan sebagai anode, sedangkan lembar tipis tembaga murni sebagai katode. Proses secara keseluruhan merupakan transfer atom tembaga dari anode ke katode seperti pada persamaan dan gambar di bawah ini.


Tembaga teroksidasi lebih cepat dibanding perak dan emas. Oleh karena itu perak atau emas biasanya digunakan sebagai pengotor tembaga yang mengumpul di bawah anode pada sel elektrolisis.
Kumpulan logam berharga ini disebut sebagai lumpur-anode yang biasanya cukup untuk membayar biaya pemurnian atau electrorefining tembaga.
Materi Terkait
- 1 Mengenal Susunan Deret Volta
- 2 Macam-macam Baterai dan Sel Bahan Bakar
- 3 Mengenal Elektrolisis, Sel Elektrolisis, dan Susunan Sel Elektrolisis
- 4 Cara Menentukan dan Meramalkan Reaksi Elektrolisis
- 5 Mengenal Hukum Faraday, Bunyi Hukum Faraday, dan Cara Menggunakan Hukum Faraday
- 6 Aplikasi dan Penerapan Elektrolisis
- 7 Pengertian Korosi, Faktor Penyebab Korosi, dan Tehnik Pencegahan Korosi