Mengenal Reaksi Asam dan Basa
Reaksi Asam Basa
Di dalam air, asam akan menghasilkan ion hidrogen (H+) dan basa menghasilkan ion hidroksida (OH-).Ketika asam bereaksi dengan basa, ion-ion ini akan saling menetralkan. Sehingga reaksi asam dengan basa sering juga disebut sebagai reaksi netralisasi.
Salah satu contoh reaksi asam basa adalah garam dapur (NaCl).
Jadi salah satu hasil dari reaksi netralisasi adalah air dan senyawa ionik, yang disebut garam.
Garam terdiri atas kation yang berasal dari basa dan anion yang berasal dari asam.
Reaksi netralisasi garam disebut juga reaksi penggaraman.
Semua garam termasuk dalam kategori elektrolit kuat.
Perhatikan senyawa yang dihasilkan oleh reaksi asam-basa di bawah ini
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Ketika basa bereaksi dengan asam monoprotik, maka hanya akan dihasilkan satu jenis garam.
Sedangkan, jika basa bereaksi dengan asam poliprotik, maka bisa dihasilkan lebih dari satu jenis garam tergantung dari reaksi netralisasi yang dilakukannya.
Sebagai contoh reaksi antara H2SO4 dengan NaOH. Reaksi H2SO4 dengan NaOH dapat menghasilkan dua jenis garam, yaitu natrium sulfat (Na2SO4) dan natrium bisulfat (NaHSO4).
Pada reaksi asam dan basa yang nilai konsentrasinya sama. Tidak selamanya menghasilkan larutan yang netral, karena hal ini bergantung pada kekuatan dari asam dan basa tersebut.
Salah satu cara menetralkan asam dengan basa atau sebaliknya adalah dengan cara melakukan titrasi.
Apa itu Titrasi ?
Titrasi adalah penambahan larutan baku atau bisa juga larutan yang telah diketahui nilai konsentrasinya dengan bantuan sebuah indikator.
Untuk reaksi penetralan, indikator yang digunakan adalah indikator yang berubah warna pada pH netral atau mendekati netral (berkisar antar 6 hingga 8, jika menggunakan pH meter).
Indikator yang sering digunakan untuk meguji reaksi asam basa adalah fenolftalein. Selain itu ada juga indikator lainnya seperti metil merah dan bromtimol biru.

Dua Hal Yang Penting Kita Perhatikan Saat Menggunakan Titrasi
Terdapat dua hal penting yang perlu kita perhatikan pada saat menggunakan titrasi, diantaranya adalah:- Titik akhir titrasi
Titik akhir titrasi disini adalah saat dimana indikator mengalami perubahan warna. - Titik Ekivalen
Titik ekivalen disini adalah saat jumlah mol H+ sama dengan jumlah mol OH-.
Biasanya ditunjukkan menggunakan harga pH.
Jika larutan asam ditetesi dengan larutan basa, maka pH larutan akan mengalami kenaikan.
Sebaliknya, jika larutan basa ditetesi dengan larutan asam maka pH-nya akan mengalami penurunan.
Grafik yang menyatakan perubahan pH pada penetesan asam dengan basa disebut dengan kurva titrasi.
Kurva titrasi berbentuk huruf S, yang pada titik tengahnya merupakan titik ekivalen.
Ada tiga jenis kurva titrasi, yaitu
- Penetralan Asam Kuat oleh Basa Kuat
- Penetralan Asam Lemah oleh Basa Kuat
- Penetralan Basa Lemah oleh Asam Kuat
1. Penetralan Asam Kuat oleh Basa Kuat
Jenis pertama dari penetralan asam kuat oleh basa kuat adalah kurva titrasi antara larutan HCl dengan NaOH.Perhatikan, sebanyak 25 mL larutan HCl 0,1 M dititrasikan dengan larutan NaOH 0,1 M menghasilkan kurva titrasi seperti gambar di bawah.

Dari kurva titrasi di atas terlihat bahwa pH larutan naik sedikit demi sedikit, tetapi perubahan yang cukup drastis terjadi sekitar titik ekivalen.
Titik ekivalen tercapai pada saat volume NaOH yang ditambahkan 50 mL, yaitu pada saat pH larutan 7 (netral).
Indikator yang bisa digunakan adalah fenolfalein.
2. Penetralan Asam Lemah oleh Basa Kuat
Jenis kedua dari penetralan asam lemah oleh basa lemah adalah kurva titrasi antara asam asetat dengan NaOH.Berikut ini tampilan contoh kurva titrasi antara asam asetat dengan NaOH 0,1 M.
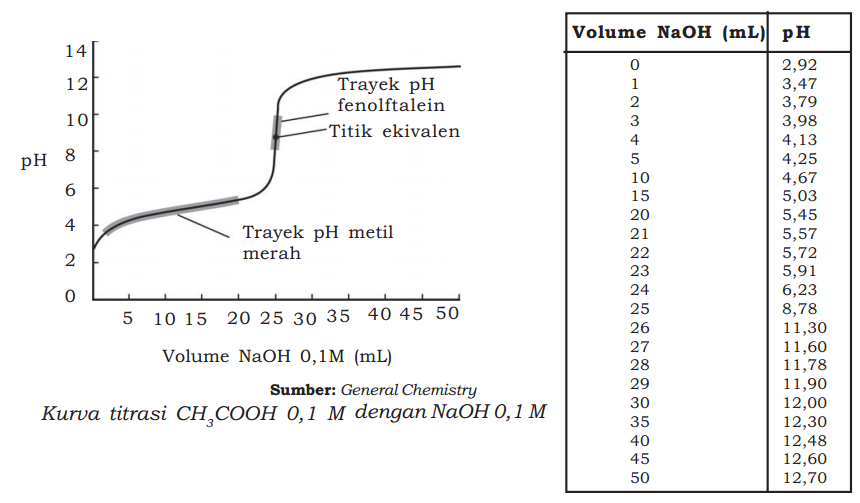
Pada gambar kurva di atas dapat kita lihat bahwa pada saat netral (pH = 7) volume basa lebih sedikit daripada volume asam.
Sedangkan titik ekivalen terjadi pada pH 8,78. Oleh karena itu indikator yang digunakan bisa indikator fenolftalein.
3. Penetralan Basa Lemah oleh Asam Kuat
Jenis kedua dari penetralan basa lemah oleh asam kuat adalah kurva titrasi antara NH3 dengan HCl.Perubahan pH pada penetralan basa lemah oleh asam kuat, misalnya pada 25 mL larutan NH3 0,1 M yang dititrasi dengan larutan HCl 0,1 M sedikit demi sedikit hingga mencapai 50 mL. Lebih jelasnya perhatikan gambar di bawah ini.
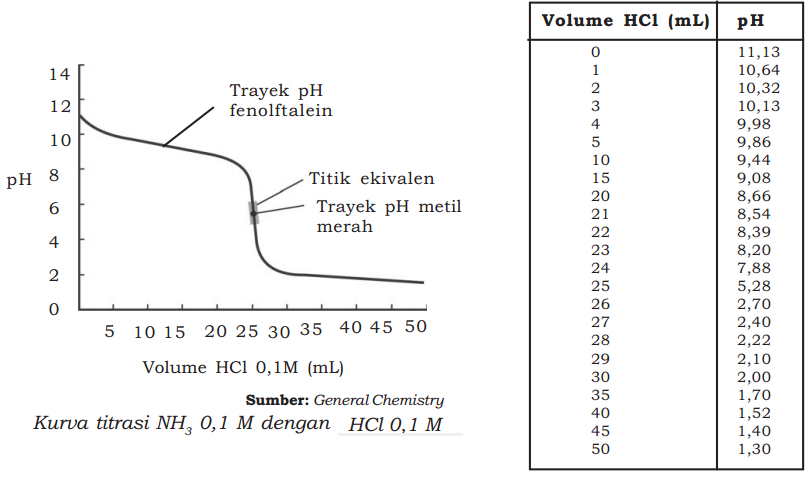
Pada kurva di atas terlihat bahwa titik ekivalen pada saat pH di bawah 7 jatuh pada pH 5,28.
Untuk menunjukkan titik ekivalen, kita dapat menggunakan indikator metil merah (trayek pH = 4,2 - 6,3).
Contoh Soal
Diketahui, dilakukan percobaan pada larutkan HCl 0,4 M dititrasi dengan larutan NaOH. Diperoleh titik akhir titrasi terjadi pada 25 mL larutan HCl dengan 100 mL larutan NaOH.Tentukan molaritas larutan NaOH-nya!
Jawab:
Vasam = 25 mL
Vbasa = 100 mL
Vasam = Vbasa x Mbasa
0,4 x 25 = 100 x Mbasa
Mbasa = (25 x 0,4) / 100
Mbasa = 0,1 M