Macam-macam Dasar Pengelompokan Unsur-Unsur Hingga Terbentuk Tabel Priodik
Table of Contents
Artikel kali ini adalah membahas bagaimana asal mula terbentuknya tabel priodik. Tabel priodik tidak langsung dibuat setelah mengetahui unsur-unsur yang ada di dunia. Awalnya unsur-unsur hanya dibagi ke dalam unsur logam dan non logam. Seiring berjalannya waktu dan unsur yang ditemukan semakin kompleks, maka mulailah dibuat penggolongan unsur-unsur yang lebih rinci dan kini dikenal sebagai tabel priodik. Berikut ini adalah macam-macam dasar penggolongan unsur dari dulu hingga sekarang.
Baca Juga
1. Pengelompokan Unsur Berdasarkan Logam dan Non Logam
Awalnya unsur-unsur yang dikenal masih sangat sedikit. Oleh karena itu orang-orang hanya membagi unsur-unsur ke dalam kelompok logam dan non-logam. Namun pengelompokan ini masih terlalu umum karena ternyata dalam berbagai unsur logam maupun non-logam masih ada berbagai variasi dan sifat unsur-unsur yang dapat dibedakan.2. Hukum Triade Dobereiner
Sejak unsur logam dan non-logam sudah tidak lagi sesuai untuk digunakan. Pada tahun 1829, Johan Wolfgang Dobereiner menemukan adanya kemiripan sifat antara beberapa unsur. Melalui penemuannya ini lalu unsur dikelompokkan menurut kemiripan sifat yang ada. Hasil penggolongan Johan Wolfgang Dobereiner membagi ke dalam tiga unsur, sehingga dikenal sebagai Triade.Jika unsur-unsur yang letaknya dalam satu triade disusun berdasarkan kenaikan massa atomnya, maka kita dapat melihat bahwa massa atom dan sifat-sifat unsur yang kedua adalah rata-rata dari massa atom unsur pertama dan ketiga.
Penemuan di atas memperlihatkan adanya hubungan antara massa atom dengan sifat-sifat unsur.
Berikut ini adalah contoh penggolongan triade milik Johan Wolfgang Dobereiner: | Contoh-contoh kelompok triade | |
|---|---|
| Kelompok | Nama unsur |
| Li, Na, K | litium, natrium, kalium |
| Ca, Sr, Ba | kalsium, stronsium, barium |
| Cl, Br, I | klorin, bromin, iodin |
Misalnya yang kita gunakan adalah Cl, Br, dan I.
ArBr = (ArCl + ArI ) / 2
ArBr = (35,5 + 127) / 2 = 81,25
Kelemahan pengelompokan milik Johan Wolfgang Dobereiner ini terletak pada kenyataan bahwa jumlah unsur yang memiliki kemiripan sifat tidak hanya 3 buah.
| Daftar Unsur Triade Dobereiner | ||||
|---|---|---|---|---|
| Triade-1 | Triade-2 | Triade-3 | Triade-4 | Triade-5 |
| Li | Ca | S | Cl | Mn |
| Na | Sr | Se | Br | Cr |
| K | Ba | Te | I | Fe |
| K | Ba | Te | I | Fe |
3. Hukum Oktaf Newlands
Tahun 1864, Seorang ilmuan bernama A.R. Newlands mengumumkan penemuannya yang disebut hukum Oktaf. Pada hukum Oktaf, unsur-unsur disusun berdasarkan kenaikan massa atom relatifnya.Diketahui bahwa unsur dengan selisih 1 oktaf, seperti unsur nomor 1 dengan 8, unsur nomor 2 dengan 9, dan sebagainya menunjukkan adanya kemiripan sifat atau bisa dikatakan terjadi perubahan sifat unsur yang teratur.
Kecenderungan ini dinyatakan sebagai hukum Oktaf Newland, yang berbunyi:
Jika unsur disusun dari kenaikan massa atom yang dimilikinya maka sifat unsur tersebut akan berulang setelah unsur kedelapan.
| Pengelompokan Unsur dalam Oktaf Newlands | ||||||
|---|---|---|---|---|---|---|
| Do-1 | Re-2 | Mi-3 | Fa-4 | Sol-5 | La-6 | Si-7 |
| H | Li | Be | B | C | N | O |
| F | Na | Mg | Al | Si | P | S |
| Cl | K | Ca | Cr | Ti | Mn | Fe |
| Co, Ni | Cu | Zn | Y | In | As | Se |
| Br | Rb | Sr | La, Ce | Zr | Mo, Di | Ro, Ru |
| Pd | Ag | Cd | U | Sn | Sb | I |
| Te | Cs | Ba, V | Ta | W | Nb | Au |
| Pt, Ir | Os | Hg | Tl | Pb | Bi | Th |
Ketika daftar Oktaf Newlands disusun, unsur-unsur dengan jenis gas mulia belum ditemukan. Oleh karena itu pengelompokan ini hanya sesuai untuk unsur-unsur ringan atau dengan Ar yang rendah.
4. Hukum Mendeleyev
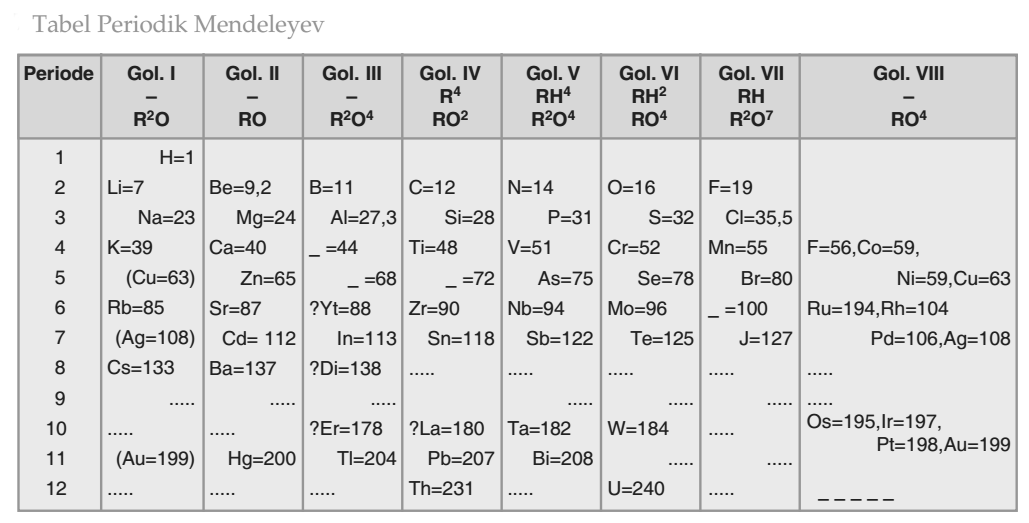
Pada tahun 1869, seorang sarjana berkebangsaan Rusia Dmitri Ivanovich Mendeleyev melakukan pengamatannya terhadap 63 unsur yang sudah dikenal saat itu. Dmitri Ivanovich Mendeleyev menyimpulkan bahwa sifat-sifat unsur pada tabel priodik ditentukan dari massa atom relatifnya. Artinya jika unsur-unsur disusun secara menurut berdasarkan kenaikan massa atom relatifnya, maka sifat-sifat tertentu akan berulang secara periodik.Mendeleyev juga saat itu membuat suatu daftar periodik unsur. Unsur-unsur yang dibuat Mendeleyev memiliki persamaan sifat dan ditempatkan dalam satu lajur vertikal yang disebut sebagai golongan.
Mendeleyev, lebih menekankan pada persamaan sifat dari suatu unsur dibandingkan dengan kenaikan massa atom relatifnya, sehingga terdapat tempat-tempat kosong dalam tabel periodik yang disusun milik Mendeleyev tersebut.
Tempat-tempat kosong ini yang akan diisi unsur-unsur yang belum ditemukan atau belum diketahui. Di kemudian hari ramalan Mendeleyev ini terbukti dengan ditemukannya unsur-unsur yang mempunyai sifat-sifat yang mirip sesuai ramalannya. Namun ada kelemahan dari Tabel Priodik milik Mendeleyev ini.
Kelemahan Tabel Periodik Mendeleyev adalah sebagai berikut.
- Menempatkan unsur yang tidak sesuai dengan kenaikan massa atom relatifnya karena lebih memperhatikan kemiripan sifat unsur dalam satu golongannya.
- Masih banyak unsur yang belum diketahui pada saat itu sehingga dalam tabel terdapat banyak tempat kosong.
5. Tabel Periodik Modern
Tahun 1914, seorang ilmuan bernama Henry G. J. Moseley menemukan bahwa urutan suatu unsur dalam tabel periodik sesuai dengan kenaikan nomor atomnya. Tabel periodik modern disusun berdasarkan kenaikan nomor atom dan kemiripan sifat dari unsur tersebut. Tabel periodik modern ini disebut juga sebagai penyempurnaan Tabel Periodik Mendeleyev.
Tabel periodik berbentuk panjang, terdiri atas lajur vertikal atau golongan yang disusun menurut kemiripan sifat dan lajur horizontal atau periode yang disusun berdasarkan kenaikan nomor atomnya.
- Lajur vertikal (golongan) ditulis dengan angka Romawi, yang terdiri dari 18 golongan.
-
Golongan A (Golongan Utama)
Gol.
IA : Alkali Gol.VA : Nitrogen
IIA : Alkali Tanah VIA : Kalkogen
IIIA : Aluminium VIIA : Halogen
IVA : Karbon VIIIA (0): Gas Mulia - Golongan Transisi/Golongan Tambahan (Golongan B), terbagi atas:
- Golongan Transisi (Gol. B), yaitu : III B, IV B, V B, VI B, VII B, VIII B (VIII), I B, dan II B.
- Golongan Transisi Dalam, terbagi atas dua deret yaitu :
- Deret Lantanida adalah unsur yang mempunyai kemiripan sifat dengan 57La.
- Deret Aktinida adalah unsur yang mempunyai kemiripan sifat dengan 89Ac.
Pada periode 6 golongan III B terdapat 14 unsur yang sifatnya sangat mirip, yaitu unsur-unsur Lantanida. Demikian juga pada periode 7 yaitu unsur-unsur Aktinida. Agar tabel tidak terlalu panjang, unsur-unsur ini ditempatkan tersendiri pada
bagian bawah sistem periodik.
Golongan B terletak di antara Golongan IIA dan IIIA. Semua unsur yang berada dalam satu golongan mempunyai persamaan sifat karena mempunyai elektron valensi atau elektron di kulit terluar yang sama. -
Golongan A (Golongan Utama)
- Lajur Horizontal (Periode) ditulis dengan angka Arab terdiri dari 7 periode, yaitu.
- Periode 1 berisi 2 unsur.
- Periode 2 berisi 8 unsur.
- Periode 3 berisi 8 unsur.
- Periode 4 berisi 18 unsur.
- Periode 5 berisi 18 unsur.
- Periode 6 berisi 32 unsur.
- Periode 7 berisi 23 unsur (belum lengkap).
