Bagaimana Cara Meramalkan Bentuk Molekul
Bagaimana Cara Meramalkan Bentuk Suatu Molekul
Sebelumnya dalam teori VSEPR, dijelaskan bahwa bentuk molekul dapat diramalkan dari susunan pasangan elektron yang berada di sekitar atom pusat berdasarkan tolakan pasangan-pasangan elektron tersebut.Jadi, untuk dapat meramalkan bentuk suatu molekul, kita harus terlebih dahulu mengetahui jumlah pasangan elektron yang ada di sekitar atom pusat.
Jumlah pasangan elektron secara umum dapat ditentukan dengan cara menggambarkan struktur Lewis dari molekul tersebut.
Tahap Meramalkan Bentuk Molekul
Berikut ini adalah langkah-langkah atau tahap-tahap untuk meramalkan bentuk molekul:- Gambar rumus titik elektron dari molekul.
- Hitung jumlah pasangan elektron ikatan dan pasangan elektron bebas di sekitar atom pusat.
- Tentukan bentuk molekulnya dengan mengacu pada gambar pada artikel Bentuk molekul dalam teori VSEPR.
Untuk lebih jelasnya perhatikan contoh di bawah ini.
1. Untuk Bentuk molekul CO2
Langkah 1
Rumus titik elektron dari CO2 adalah
Langkah 2
Di sekitar atom pusat terdapat 4 pasang elektron ikatan yang tidak memiliki pasangan elektron bebas.Ikatan rangkap dua CO diperlakukan seperti ikatan tunggal sehingga kita dapat menganggap bahwa hanya terdapat 2 pasang elektron ikatan.
Langkah 3
Seperti gambar Bentuk molekul dalam teori VSEPR, molekul H2O memiliki tipe AB2E2 sehingga molekul CO2 diramalkan memilil bentuk V atau linier.
2. Bentuk molekul H2O
Langkah 1
Rumus titik elektron H2O adalah sebagai berikut.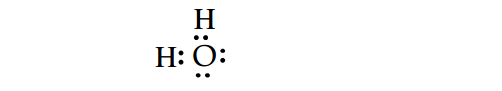
Langkah 2
Di sekitar atom pusat terdapat 2 pasang elektron ikatan dan 2 pasang elektron bebas.Langkah 3
Sesuai Bentuk molekul dalam teori VSEPR, molekul H2O memiliki tipe AB2E2 sehingga molekul H2O diramalkan memiliki bentuk V atau bengkok.
3. Bentuk molekul CH4
Langkah 1
Rumus titik elektron dari CH4 adalah sebagai berikut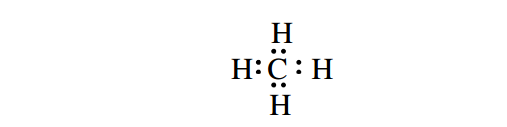
Langkah 2
Di sekitar atom pusat terdapat 4 (empat) pasang elektron ikatan dan tidak terdapat pasangan elektron ikatan.Langkah 3
Sesuai Bentuk molekul dalam teori VSEPR, molekul CH4 memiliki tipe AB4 sehingga molekul CH4 diramalkan memiliki bentuk tetrahedral.
Baca Juga
4. Bentuk molekul ClF3
Langkah 1
Rumus titik elektron ClF3 adalah sebagai berikut
Langkah 2
Di sekitar atom pusat terdapat 3 (tiga) pasang elektron ikatan dan 2 pasang elektron bebas.Langkah 3
Sesuai Bentuk molekul dalam teori VSEPR, molekul ClF3 memiliki tipe AB3E2 sehingga molekul ClF3 diramalkan memiliki bentuk menyerupai huruf T.